Энергия ионизации и ее потенциал
Дата публикации: 20 октября 2020
Ионы
С греческого ión переводится как идущий.
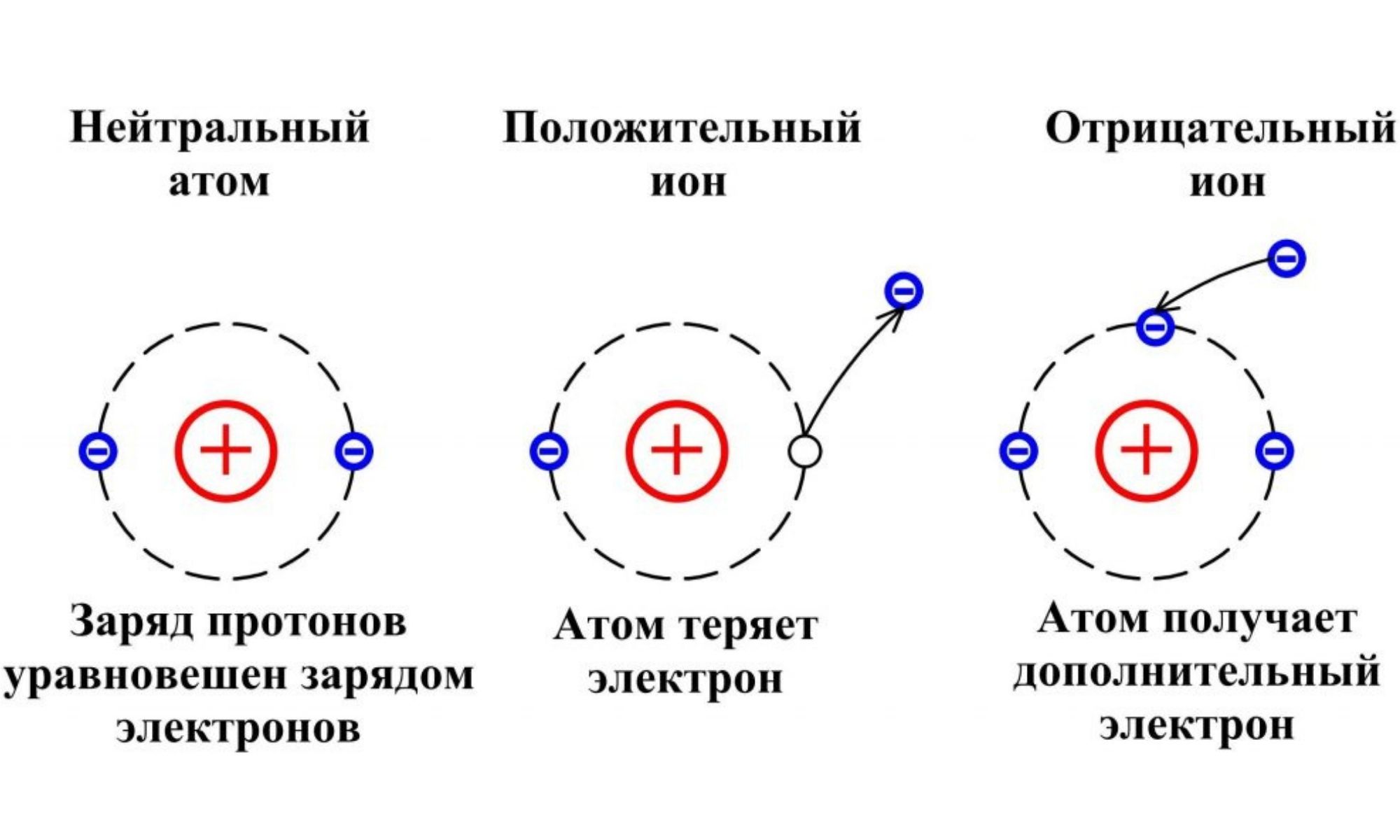
Ионы-это частицы с положительным или отрицательным зарядом, в которые превращаются атомы или группы атомов при потере или присоединении электронов, или других заряженных частиц.
Первым ввел термин Ионы М.Фарадей в 1834 году. Он изучал действие электрического тока на растворы щелочей, кислот, солей и выдвинул предположение, что электропроводность этих растворов обусловлена движением ионов.
Ионы могут быть:
- простые(Cl-,Na+);
- сложные (NaSO42-,NH4+).
Они могут быть:
- положительно заряженными(Na+,Mg2+);
- отрицательно заряженными(Cl-,Br-).
Величина заряда иона зависит от количества присоединенных или потерянных частиц.
Например:
- при потере или присоединении одного электрона получаются однозарядные ионы(Cl-,Na+);
- при потере или присоединении двух электронов получаются двухзарядные ионы(Mg2+,Ca2+);
и так далее.
В растворе или расплаве электролита их движение хаотично и лишь при пропускании электрического тока через раствор или расплав их движение становится направленным. К катоду (отрицательно заряженный электрод) движение осуществляют положительно заряженные ионы (катионы). К катионам относятся ионы металлов, водорода и ион амония(K+,Na+,Fe2+,H+,NH4+). А к аноду (положительно заряженный электрод) движутся отрицательно заряженные ионы(анионы). К анионам относятся ионы кислотных остатков, гидрокси-ион и другие(NO3-,Cl-,OH-).
Все растворы электролитов электронейтральны, потому что сумма зарядов анионов и катионов равны между собой.
Ионы в составе молекул вещества
Ионы могут быть в составе молекул различных веществ.
Ионы можно встретить как самостоятельные частицы во всех агрегатных состояниях веществ:жидкостях, кристаллах, газах.
В газах
В газах ионы образуются чаще под действием частиц с большей энергией, различных лучей (рентгеновских, гамма, ультрафиолетовых) или при фотоионизации. Ионы, образовавшиеся таким способом недолговечные и быстро нейтрализуются путем соединения. При термической ионизации (при повышении температуры и понижении давления) -термическая диссоциация с отделением электрона происходит переход газа в состояние плазмы.
В природных условиях ионы образуются при разряде молнии, от солнечных лучей и космического излучения.
Ионы в организме
Ионы в организме живых существ выполняют множество различных функций: обусловливают механизм проникновения клеточных мембран, регулируют сокращения мышечных волокон, способствуют проведению импульса возбуждения по нервным волокнам и др. Состояние диссоциации и ассоциации ионов в молекулы в тканевых жидкостях и клетках организма поддерживается на определенном уровне в норме. Но при некоторых состояниях может смещаться.
Энергия ионизации
Энергия ионизации — это наименьшая энергия, которую нужно затратить для удаления электрона из свободного атома.
Обозначается буквой Е. Измеряется в эВ (электронвольтах) или ккал(килокалориях).
Ее иногда называют первый ионизационный потенциал. Потенциал ионизации связан с энергией ионизации. Обозначается потенциал ионизации буквой U. Измеряется в В(вольтах).
Зависимость энергии ионизации с потенциалом ионизации выражается по формуле:
E=Ue
е-величина элементарного электрического заряда.
Величина энергии ионизации является внутренним свойством и не имеет отношения к способу ионизации. Потенциал ионизации- исторически полученная величина при первом методе ионизации электронным ударом.
Что такое ионизационные потенциалы
Ионизационный потенциал или потенциал ионизации — это та работа, которую нужно потратить, чтоб оторвался электрон от атома и при этом был удален на бесконечно большое расстояние (т. е. таким образом, чтоб не попадал под действие положительно заряженного ядра).
Потенциалы ионизации бывают:
- первого порядка(I1) —это количество энергии, затрачиваемое на отрыв 1-го электрона;
- второго порядка(I2)—это количество энергии, затрачиваемое на отрыв от одновалентного иона с положительным зарядом;
- третьего порядка(I3);
- и т. д.
Проще и легче отщепить от атома первый электрон. Для отрыва следующих электронов потенциал ионизации будет расти т. к. увеличится свободный заряд иона, притягивающего электроны.
Отщепить первый электрон труднее всего у инертных газов, потому что их замкнутые электронные оболочки обладают исключительной стабильностью. Соответственно второй и третий электроны будет оторвать еще сложнее.
Легче всего отщепить первый электрон у атомов щелочных металлов т. к. он единственный валентный электрон.
В одной подгруппе электрон будет иметь наименьшую связь и более легко отрываться, чем выше у него порядковый номер. Имея аналогичную электронную структуру атому проще потерять электрон в том случае, если он находится дальше от положительно заряженного ядра.
При наименьшем ионизационном потенциале атома произойдет наиболее легкая отдача электрона.
Еще одной важной характеристикой атома является сродство к электрону.
Сродство к электрону — это величина энергии, которая выделяется или поглощается при присоединении электрона к свободному атому и превращении его в отрицательный ион.
Легче всего электроны присоединяют к себе те атомы, которые достраивают внешнюю орбиту т. е. по конфигурации похожи на благородные газы. К таким элементам можем отнести те, у которых на внешней оболочке от 4 до 7 электронов. Легче всего отдают электроны атомы элементов, у которых после отдачи электрона остается восьмиэлектронная оболочка. Это элементы, у которых на наружной оболочке находится 1,2 или 3 электрона.
Нет зависимости величины сродства элемента к электору и его ионизационного потенциала. Это означает, что сродство элемента к электрону не будет больше при его большем ионизационном потенциале. На эту величину сильное влияние оказывает структура электронной оболочки атома. Например, при высоком ионизационном потенциале инертных газов у них большая устойчивость структуры электронных оболочек, по этой же причине очень маленькое сродство к электрону.